Оформление возврата финансовых средств покупателю за приобретенный товар, который не подошел: основания и условия возмещения денег, порядок действий
Наряду с заменой неподходящего товара, устранением недостатков, снижением цены изделия, полное возмещение денежных средств за товар является одной из форм выполнения продавцом своих обязательств перед покупателем.
В соответствии с российским законодательством, инициировать возврат денег потребитель может как в отношении товаров с обнаруженным в нем дефектом, так и в отношении изделий надлежащего качества.
Возврат денежных средств за покупку: законодательная база вопроса
Правовое регулирование оснований, условий и порядка реализации возврата денежных средств за приобретенный товар осуществляется Законом «О защите прав потребителей» (ФЗ № 2300-1 от 7 февраля 1992 года). В статьях 18-25 ЗоЗПП излагаются положения, касающиеся:
- общих прав покупателя при обнаружении в изделии изъянов;
- сроков обращения к продавцу с претензией касательно купленного товара;
- порядка устранения недостатков и возмещения убытков за приобретение изделия;
- ответственности за выполнение продавцом своих обязательств;
- порядка расчетов с покупателем в случае возврата товара, к качеству которому нет претензий.
Основания для возврата денежных средств покупателю
В соответствии с нормами, изложенными в ЗоЗПП, право требовать полную компенсацию всех уплаченных денежных средств покупатель может в ситуациях, когда:
- был приобретен некачественный или просроченный продукт;
- товар не имеет изъянов, однако не устраивает покупателя по параметрам цвета, формы, размера и прочим личным причинам (под это условие подпадают не все категории товаров);
- при реализации товара продавец предоставил покупателю недостоверные сведения об изделии.
Порядок возврата денежных средств покупателю
Сталкиваясь с необходимостью сдачи товара надлежащего качества в магазин и получения за него финансовой компенсации, покупатель изделия должен помнить тот факт, что на законодательном уровне регламентированы основные требования к товару и срокам обращения к продавцу. Вернуть деньги за покупку будет возможно, если:
- возвращаемое изделие не было в эксплуатации и в полной мере сохранило свой товарный вид, характеристики;
- на товаре сохранены производственные ярлыки, бирки, пломбы и прочие элементы маркировки;
- сохранена вся необходимая документация на товар;
- покупатель обращается в магазин с требованием возврата денежных средств в допустимый законом 14-дневный срок;
- товар не входит в перечень товаров, не подлежащих обмену или возврату, утвержденный Постановлением Правительства от 19.01.1998 за номером 55.
Возврат средств, который инициируется покупателем по причине выявления в изделии серьезного изъяна, может быть произведен в течение гарантийного срока, а при отсутствии такового — в течение 2 лет с момента покупки.
Документальным основанием для реализации данной процедуры в обоих случаях становится письменное заявление от покупателя на возмещение денежных средств за приобретенный товар.
Как оформить возврат от покупателя: пошаговый алгоритм
Столкнувшись с необходимостью возврата товара в магазин и возмещения денежных средств, покупателю следует выполнить ряд следующих действий:
- Обратиться в точку покупки и сообщить продавцу об имеющейся проблеме.
- Предъявить пакет документов, сопровождающий покупку.
- Составить письменное заявление на возмещение финансовых средств.
- Ознакомиться с актом осмотра изделия, составленным в магазине в ответ на обращение. В некоторых случаях для возмещения средств за товар с дефектом магазином может быть инициирована техническая экспертиза, подтверждающая факт возникновения поломки по вине производителя (торговой точки).
- После составления акта (получения результатов экспертизы) следует ожидать перечисления финансовых средств в полном объеме.
Какие документы понадобятся для оформления возврата?
Для оформления возврата денежных средств покупатель должен подать в точку продажи:
- заявление на имя руководителя магазина на возврат товара и возмещение полной суммы денежных средств за покупку с указанием причины (аргументировать причину необязательно, если товар надлежащего качества сдается в течение 14 дней);
- копию паспорта покупателя;
- непосредственно сам товар;
- техническую документацию на изделие и гарантийный талон;
- чек об оплате покупки (при отсутствии чека — иные подтверждающие покупку бумаги, выписки по карте, показания свидетелей и пр.).
Правила совершения возврата: наличный и безналичный расчет
В зависимости от формы оплаты покупки потребитель имеет право получить расчет полной суммы за товар в наличной или безналичной форме. При оплате наличными средствами деньги компенсируются из главной кассы по расходному ордеру под личную подпись покупателя.
При возврате безналичной оплаты средства поступают на ту карту, с которой совершалась покупка.
Сроки возврата денежных средств
Закон «О защите прав потребителей» устанавливает трехдневный срок для возмещения денежных средств за возвращенный качественный товар. При оплате в безналичной форме возврат денег на карту может осуществляться в течение 5 банковских дней.
В заключение отметим: ответственность за перечисление денежных средств в регламентированные законом временные рамки несет именно продавец. В случае задержки поступления средств за возвращенный товар потребитель имеет полное право выдвигать магазину претензии с требованием выплаты неустойки за каждый просроченный день в размере 1% от суммы покупки. В случае если и эти претензии продавцом игнорируются, может иметь место обращение потребителя в органы Роспотребнадзора, прокуратуры и даже судебные инстанции.
Расчет с подотчетными лицами — нормативные документы
Регулирование расчетов с подотчетными лицами в 2020-2021 годах: нормативная база
Подоточетником называют сотрудника фирмы (или ИП), которому работодатель авансом выдает денежные средства в целях совершения покупок, необходимых для ведения своей деятельности, как правило на приобретение канцтоваров, хозпринадлежностей, ГСМ, а также на командировочные и представительские расходы.
Регламентируются отношения участников данных правоотношений следующими основными нормативными актами:
- указанием Банка России «О порядке ведения кассовых операций юридическими лицами и упрощенном порядке ведения кассовых операций индивидуальными предпринимателями и субъектами малого предпринимательства» от 11.03.2014 № 3210-У;
ВНИМАНИЕ! С 30.11.2020 в указ 3210-У внесли ряд поправок. Так, например, согласно новым правилам распорядительный документ можно составить на несколько выдач наличных денег одному или нескольким работникам. В этом случае нужно указать фамилию, сумму и срок, на который выдают деньги, по каждому работнику.
Какие еще нововведения в порядке учета кассовых операций вступили в действие, рассказали эксперты КонсультантПлюс. Получите пробный доступ к системе К+ и бесплатно переходите в обзорный материал.
- приказом Минфина РФ «Об утверждении Плана счетов бухгалтерского учета финансово-хозяйственной деятельности организаций и инструкции по его применению» от 31.10.2000 № 94н;
- законом «О бухгалтерском учете» от 06.12.2011 № 402-ФЗ;
- КоАП РФ;
- Трудовым кодексом РФ.
Кроме того, к правоотношениям с подотчетными лицами следует применять письма разъяснительного характера, изданные структурами финансового ведомства РФ: Минфином, ФНС, Банком России. Примером такого разъяснения могут служить письмо Минфина РФ от 21.07.2017 № 09-01-07/46781 (о возможности выдачи под отчет денег в безналичной форме).
Расчеты с подотчетниками и указание Банка России № 3210-У
Данный документ является основным актом, устанавливающим правила выдачи подотчетных средств. В соответствии с п. 6.3 указания № 3210-У руководитель фирмы (или ИП) вправе выдать работнику наличные средства в целях осуществления расходов, связанных с деятельностью этой фирмы (или предпринимателя). Это означает, что физлицо, не являющееся сотрудником данного хозсубъекта, деньги под отчет получить не сможет.
При этом понятие «работник» указание № 3210-У трактует несколько иначе, чем другие нормативные акты, в частности ТК РФ. Согласно п. 5 указания № 3210-У под работником подразумевается физлицо, с которым у хозсубъекта имеется договор трудовой или гражданско-правовой направленности. Эта же позиция Банка России по отношению к трактовке понятия «работник» прослеживается и в его письме от 02.10.2014 № 29-Р-Р-6/7859. Таким образом, наличность под отчет вправе получить не только сотрудник, осуществляющий трудовые функции, но и подрядчик, с которым у данного хозсубъекта заключен гражданско-правовой договор.
Перечислим другие важные правила выдачи подотчетной наличности, закрепленные в п. 6.3 указания № 3210-У:
- Выдача средств под отчет разрешается на совершение расходов, связанных с хоздеятельностью лица, работником которого подотчетник является.
- Выдача подотчетных сумм производится на основании оформленного сотрудником заявления, в котором он указывает: размер необходимой для покупки суммы и срок, который потребуется для совершения этой покупки. На оформленном таким образом заявлении необходимо проставить дату и далее отдать его на визу руководителю. Вместо заявления разрешается выдавать деньги на основании приказа руководителя компании, в котором также указывается их размер, целевая направленность и получатель подотчетных сумм. Приказ должен содержать регистрационный номер и дату, а также подпись руководителя (письмо ЦБ РФ от 06.09.2017 № 29-1-1-ОЭ/2064).
- Передача из кассы денежных средств сотруднику сопровождается оформлением расходного кассового ордера формы ОКУД 0310002.
- Выдача следующей суммы подотчетнику возможна даже при наличии долгов по предыдущим отчетным суммам. Эту поправку (как и разрешение выдавать подотчетные деньги на основании приказа руководителя) в указание № 3210-У внесены указанием ЦБ РФ от 19.06.2017 № 4416-У (вступило в силу 19.08.2017).
- По истечении установленныго работодателем количества дней, отсчитываемых от последнего дня периода, на который выдавались подотчетные суммы, работник обязан представить авансовый отчет о произведенных им расходах, сопроводив его подтверждающей первичной документацией.
Пример определения даты возврата подотчетных сумм от КонсультантПлюс
Деньги выданы 12 марта 2021 г. на срок до 19 марта 2021 г. включительно. Срок, установленный руководителем для представления авансового отчета, составляет три рабочих дня после дня истечения срока, на который выданы наличные под отчет. В соответствии с инструкцией по порядку расчетов с подотчетными лицами для возврата неизрасходованных сумм отводится пять рабочих дней с момента окончания срока представления авансового отчета.
При таких условиях подотчетное лицо должно представить отчет не позднее .
Посмотреть пример полностью можно в К+, получив бесплатный пробный доступ.
- Представленная работником отчетная документация проверяется главбухом или бухгалтером, а при их отсутствии – руководителем (он же утверждает отчет, а также устанавливает сроки, в течение которых производятся окончательные расчеты с подотчетным лицом).
Необходимо ли соблюдать лимит расчетов наличными при выдаче подотчетных сумм, узнайте в КонсультантПлюс. Пробный доступ к правовой системе можно получить бесплатно.
Отражение операций с подотчетными средствами в бухгалтерском учете
Следующим документом, который стоит рассмотреть, говоря об отношениях с подотчетными лицами, является План счетов бухучета (утвержден приказом Минфина РФ от 31.10.2000 № 94н). И хотя сам Минфин не причисляет его к нормативным актам в силу его рекомендательного характера (письмо «О применении нового Плана счетов бухгалтерского учета» от 15.03.2001 № 16-00-13/05), данный документ имеет прямое отношение к отражению хозопераций с подотчетными суммами в бухгалтерском учете.
Для учета расчетов с подотчетниками планом счетов предусмотрен сч. 71. Аналитика по данному счету осуществляется по каждой подотчетной сумме.
Нормативно-правовое регулирование расчетов с подотчетными лицами: закон № 402-ФЗ
Рассмотрим перечень основных положений закона о бухучете, которые имеют отношение к оформлению локальных распорядительных документов, авансовых отчетов и подтверждающей расходы подотчетного лица первичке:
- Каждый факт хоздетельности предприятия должен быть подтвержден первичным документом. К бухучету не принимается документация, оформленная на непроизведенные хозоперации (п. 1 ст. 9 закона № 402-ФЗ).
- Вся первичная документация должна включать реквизиты, перечисленные в п. 2 ст. 9 закона № 402-ФЗ.
- Первичка составляется непосредственно при совершении того или иного факта хоздеятельности или сразу по его завершении. Ответственные лица, оформляющие первичную документацию, обязаны своевременно ее передавать сотрудникам, осуществляющим учет хозяйственных операций на предприятии (п. 3 ст. 9 закона № 402-ФЗ).
- Предприятию вменяется обязанность по организации действенного внутреннего контроля совершаемых им фактов хоздеятельности (п. 1 ст. 19 закона № 402-ФЗ).
Во исполнение последней в приведенном выше списке обязанности на предприятии оформляется, в частности, приказ руководителя, утверждающий перечень сотрудников, имеющих право получать деньги под отчет. Советуем вам оформлять перечень подотчетников именно приказом, но не перечислять указанных лиц в учетной политике. Объясняется это тем, что список сотрудников, утвержденный приказом, можно изменить в любое время. А вот вносить изменения в учетную политику можно далеко не всегда (п. 6 ст. 8 закона № 402-ФЗ).
Скачать образец приказа о подотчетных лицах вы можете по ссылке.
Трудовой кодекс: права и обязанности подотчетников
Трудовое законодательство также имеет непосредственное отношение к вопросу регулирования отношений с подотчетными лицами. Так, ТК РФ:
- распространяет на руководителя общий порядок оформления подотчетных сумм вследствие наличия у него трудовых отношений с фирмой, выдающей деньги под отчет, – ст. 16–19 ТК РФ;
- определяет обязанность возмещения работником неизрасходованных отчетных сумм в сроки, в течение которых к нему можно предъявить претензии, – ст. 137 ТК РФ;
- устанавливает ограничение сумм удержаний из зарплаты работника – ст. 138 ТК РФ;
- обязывает работодателя осуществлять компенсации работнику при использовании его личного имущества, в т. ч. денег (ст. 188 ТК РФ), компенсировать расходы при направлении в служебные командировки (ст. 165, 168, 168.1 ТК РФ).
КоАП РФ: ответственность за нарушение порядка работы с наличными
Напрямую ответственность за несоблюдение порядка выдачи подотчетных средств, установленного указанием № 3210-У, не предусмотрена. Однако некоторые ситуации (например, выдача денег под отчет и без заявления работника, и без приказа руководителя) могут повлечь за собой претензии контролирующих органов, связанные с нарушением порядка хранения денежной наличности в кассе. А вот за эти правонарушения уже предусмотрена совершенно конкретная ответственность – по ст. 15.1 КоАП.
Итоги
Порядок выдачи, возврата и учета подотчетных средств осуществляется на основе множества регламентирующих нормативных документов. При этом не менее важную роль играют также разъяснения и письма ведомств, не носящие нормативного характера.
Обзор законодательства: возврат лекарств в аптеку и маркировка БАД
Несмотря на статус самого короткого месяца в году, февраль оказался довольно насыщенным на события в законодательной сфере. Так, Минпромторг предложил уже в этом году начать эксперимент по маркировке БАД, а Минздрав вновь продлил действие свидетельств об аккредитации. Кроме этого, Роспотребнадзор прокомментировал ситуацию с возвратом лекарственных препаратов, возникшую с отменой старых Правил продажи отдельных видов товаров. Об этом и другом более подробно — в нашем традиционном обзоре фармацевтического законодательства.
Возврат ЛС в аптеку
В конце февраля Роспотребнадзор дал ответ на главный вопрос, возникший с принятием нового Постановления Правительства от 31.12.2020 г. № 2463 — можно ли вернуть лекарство в аптеку?
Напомним, что в предыдущих Правилах продажи отдельных видов товаров, лекарственные средства были включены в перечень товаров, которые не подлежат обмену или возврату. В новом документе перечень был переименован в «список товаров, не подлежащих обмену». Таким образом и возник вопрос — обменять нельзя, а что с возвратом медикаментов?
Роспотребнадзор пояснил, что «возврат» товара, согласно статье 25 закона от 07.02.1992 г. № 2300–1 «О защите прав потребителей», является его «обменом» на деньги, если аналогичного товара нет в наличии. А поскольку ЛС входят в перечень не подлежащих обмену товаров, то и никакой возврат сделать нельзя.
Маркировка БАД
В самом начале месяца Минпромторг опубликовал проект постановления о старте с 1 апреля 2021 года эксперимента по маркировке биологических активных добавок к пище средствами идентификации — по аналогии с лекарственными препаратами.
Эксперимент планируется провести в течение 10 месяцев — с 1 апреля 2021 года по 1 февраля 2022 года. Напомним, что для пилотного проекта по маркировке лекарственных препаратов понадобилось более трёх лет. При этом, изначально эксперимент должен был закончиться в 2019 году, но позже был перенесён на 2020 год.
Подробный разбор проекта постановления о маркировке БАД, а также о готовности к нему рынка, читайте в нашей отдельной статье.
Штрафы за маркировку
И в продолжение темы маркировки — новые штрафы за нарушение правил работы с ГИС МДЛП, принятые депутатами Госдумы в первом чтении. Документ предполагает добавить в КоАП две новые статьи — за ввод в оборот и оборот немаркированных ЛС, а также за непредоставление в систему обязательных сведений о маркированных товарах.
Наказанием за такие проступки будет штраф в размере от 5 до 10 тыс. рублей для должностных лиц и от 50 до 100 тыс. рублей — для юрлиц.
Таким образом, в дополнение к уже существующей статье 6.34 «Несвоевременное внесение данных в систему мониторинга движения лекарственных препаратов для медицинского применения либо внесение в неё недостоверных данных», будет введена ответственность за намеренное непредоставление информации в систему маркировки, а также за оборот ЛС без маркировки.
Названы первые кандидаты на включение в перечень ЖНВЛП 2022 года
В феврале наконец‑то состоялось первое заседание комиссии Минздрава по формированию лекарственных перечней. По его итогам в ЖНВЛП — 2022 могут войти восемь новых позиций:
| МНН | Лекарственная форма | Фармакологическая группа |
| 4-нитро-N-[(1RS)-1-(4-фторфенил)-2- (1-этилпиперидин-4-ил)этил]бензамида гидрохлорид | Концентрат для приготовления раствора для внутривенного введения | Препараты для лечения заболеваний сердца |
| Гадотеровая кислота | Раствор для внутривенного введения | Контрастные средства |
| Деламанид | Таблетки, покрытые плёночной оболочкой | Препараты, активные в отношении микобактерий |
| Булевиртид | Лиофилизат для приготовления раствора для подкожного введения | Противовирусные препараты системного действия |
| Полимиксин В | Порошок для приготовления раствора для инъекций | Антибактериальные препараты системного действия |
| Алпелисиб | Таблетки, покрытые плёночной оболочкой | Противоопухолевые препараты |
| Талазопариб | Таблетки, покрытые плёночной оболочкой | Противоопухолевые препараты |
| Помалидомид | Капсулы | Иммунодепрессанты |
Кроме этого, комиссия проголосовала за исключение из ЖНВЛП препарата «мельдоний» в лекарственной форме «капсулы».
Напомним, что свои заседания комиссия будет ещё неоднократно проводить в течение года, поэтому можно смело утверждать, что этот список не окончательный. Следите за обновлениями в нашем разделе «Новости», чтобы не пропустить информацию о том, какие ещё препараты могут пополнить или покинуть ЖНВЛП в этом году.
Продление аккредитации
Министерство здравоохранения в очередной раз продлило срок действия свидетельств об аккредитации. Все выданные ранее сертификаты специалиста и свидетельства об аккредитации продлены на 12 месяцев, если срок их действия истекает в период до 31 декабря 2021 года. Это же касается всех подобных документов, срок которых уже был продлён в соответствии с Постановлением Правительства РФ от 03.04.2020 г. № 440.
Кроме этого, Минздрав до 1 июня приостанавливает процедуру получения свидетельств об аккредитации специалиста. Исключение составляют случаи прохождения первичной аккредитации после получения высшего или среднего медицинского образования.
Работа без аккредитации
И в продолжение темы аккредитации — в Госдуме предложили отказаться от выдачи свидетельств на бумажном носителе. Таким образом медики и фармацевты смогут приступать к работе сразу после прохождения процедуры аккредитации, не дожидаясь получения бланка со свидетельством. В настоящий момент работодатели не могут взять на работу сотрудника, у которого нет свидетельства, поскольку это будет противоречить федеральному закону. При этом получение свидетельства может занимать длительное время, например, из‑за отсутствия необходимых бланков.
В связи с этим будут внесены поправки в статью 69 закона № 323‑ФЗ «Об основах охраны здоровья». Вместо бумажного свидетельства можно будет получить выписку из Единой государственной системы в сфере здравоохранения. Выписка и бумажная лицензия будут иметь одинаковую юридическую силу.
Продление квалификационных категорий
Ещё одна новость по теме продления сроков и мораториев — до 1 января 2022 года в России будет приостановлено проведение аттестации медицинских и фармацевтических работников на получение квалификационной категории. Такой приказ Минздрава был утверждён в начале февраля.
Одновременно с введением моратория на проведение аттестации министерство продлевает на 12 месяцев срок действия уже присвоенных категорий, если их срок действия истекает в период с 1 января по 31 декабря 2021 года. Это касается в том числе и категорий, которые были продлены в период с 1 февраля 2020 года по 1 января 2021 года в соответствии с Приказом от 30.04.2020 г. № 394н.
Ограничения для крупных сетей
Государственная Дума приняла в первом чтении законопроект об ограничениях на количество аптек в крупных сетях, а также о предельных выплатах по маркетинговым контрактам. Документ был внесён в Думу ещё в марте прошлого года.
Полный обзор документа и рассуждения экспертов о последствиях его окончательного принятия мы опубликовали в нашей отдельной статье.
Вкратце напомним, что документ запретит аптечным сетям открывать новые точки под своим брендом, если оборот сети составляет более 20 % объёма от всех реализованных на территории города лекарственных препаратов и медицинских изделий. Кроме этого, у первостольников появится обязанность сообщать покупателю о наличии самых дешёвых препаратов в рамках интересующего МНН.
Поправки в правила дистанционной торговли
Минздрав представил доработанный проект поправок в правила дистанционной продажи лекарственных препаратов. Главная заявленная ранее поправка осталась без изменений — для получения разрешения на торговлю ЛС аптеке больше не надо будет иметь 5 и более точек продаж. Таким образом, к дистанционной торговле будут допущены и «одиночки».
Согласно новому проекту поправок, аптекам будет разрешено заключать договоры с несколькими агрегаторами одновременно. Кроме этого, для агрегаторов исключено требование о количестве посетителей сайта не менее 500 тыс. человек за год. Для получения разрешения от Росздравнадзора на интернет-торговлю ЛС интернет-агрегатору необходимо будет иметь регистрацию в качестве юрлица не менее одного года и годовую выручку не менее 5 млрд рублей.
Последнее изменение касается доставки ЛС. В новой версии исключено упоминание о возможности доставлять препараты в пункты выдачи. Таким образом, лекарства, приобретённые дистанционно, можно будет доставлять только на адрес конечного потребителя.
Срок вступления в силу
С 1 февраля начала действовать часть 1 статьи 3 Федерального закона от 31.07.2020 г. № 247‑ФЗ «Об обязательных требованиях в Российской Федерации». Согласно ей, любые нормативные акты (приказы министерств, постановления правительства или изменения в федеральные законы), которые каким‑либо образом меняют обязательные требования, могут вступать в силу только 1 марта или 1 сентября. Но не ранее, чем по истечении 90 дней после дня официального опубликования соответствующего нормативного правового акта.
Таки образом, если вдруг Минздрав решит поменять правила отпуска или порядок оформления рецептов, то у всех фармацевтов будет минимум 90 дней, а в лучшем случае и полгода, чтобы подготовиться к грядущим изменениям.
Кстати, в самом законе «Об обязательных требованиях» много интересных моментов. Этот монументальный документ затрагивает не только фармацевтическую деятельность, но и любые сферы деятельности, контролируемые государством. Подробный разбор закона читайте в нашей специальной статье.
Реестр обязательных требований
И в дополнение к исполнению закона «Об обязательных требованиях», Минэкономразвития совместно с Минцифры сформируют специальный реестр обязательных требований, в котором будут перечислены все нормативные акты, устанавливающие требования к различным видам деятельности.
Он будет представлять собой базу данных с перечислением обязательных требований, содержащихся в различных нормативных актах: приказах, постановлениях, санитарных правилах и так далее. Для каждого требования будет дана ссылка на соответствующий документ, указан срок действия этого требования, гиперссылка на проверочный лист, а также возможная ответственность за его несоблюдение. Реестр будет размещён в открытом доступе для всех желающих.
Создание реестра было запланировано на 1 марта, с этой даты должно начаться его заполнение необходимой информацией.
Обзор основных изменений законодательства, вступивших в силу с 1 января 2021 года
Вместе с наступлением 2021 года произошли значительные изменения в нормативно-правовых актах, регулирующих работу аптеки. Требования некоторых из них фармработники знали почти наизусть, т.к. работали по ним уже десять или более лет. Конечно, все новое часто пугает, а когда еще и в таком количестве, то бывает очень сложно сориентироваться. Именно для того, чтобы не потеряться и не упустить основные изменения был подготовлен этот обзор.
Уничтожение ЛС
Утратили силу 31.12.2020:
1.Постановление Правительства Российской Федерации от 3 сентября 2010 г. N 674 «Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственны х средств и контрафактных лекарственных средств»
2.Постановление Правительства Российской Федерации от 16 января 2016 г. N 8 «О внесении изменений в Правила уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств”
Комментарий: Согласно Постановлению при вынесении уполномоченным органом решения об изъятии и уничтожении фальсифицированных ЛС и (или) недоброкачественных ЛС владелец таких ЛС обязан:
✔изъять эти ЛС из обращения, изолировать и разместить их в специально выделенном помещении (зоне) либо сообщить о несогласии с указанным решением уполномоченному органу в течение 30 дней со дня вынесения решения;
✔уничтожить изъятые лекарственные средства в течение 6 месяцев со дня вынесения решения.
Уничтожение фальсифицированных, недоброкачественных лекарственных и контрафактных ЛС проводит организация, имеющая лицензию на осуществление деятельности по сбору, транспортированию, обработке, утилизации, обезвреживанию, размещению отходов I — IV классов опасности.
Владелец недоброкачественных ЛС или организация, осуществляющая уничтожение, составляют акт об уничтожении, в котором указываются:
-дата и место уничтожения ЛС;
-ФИО лиц, принимавших участие в уничтожении, место работы и должность;
-обоснование уничтожения ЛС;
-сведения об уничтоженных средствах (наименование, лекарственная форма, дозировка, единицы измерения, серия) и их количестве, а также о таре или упаковке;
-наименование производителя ЛС;
-сведения о владельце ЛС;
-способ уничтожения ЛС.
Акт об уничтожении составляется в день уничтожения ЛС. Количество экземпляров акта определяется по числу сторон, принимавших участие в уничтожении ЛС. Акт подписывают все лица, принимавшие участие в уничтожении ЛС, и заверяется печатью организации, осуществившей уничтожение. Копия акта об уничтожении ЛС, заверенная в установленном порядке, представляется в течение 5 рабочих дней со дня его составления или в течение 5 рабочих дней со дня его получения владельцем уничтоженных лекарственных средств в уполномоченный орган с использованием электронных средств связи.
Виды аптечных организаций
Утратил силу 31.12.2020: Приказ Министерства здравоохранения и социального развития Российской Федерации от 27 июля 2010 г. N 553н «Об утверждении видов аптечных организаций».
Вступил в силу: Приказ Министерства здравоохранения РФ от 31 июля 2020 г. № 780н « Об утверждении видов аптечных организаций ».
Комментарий: Утверждены четыре вида аптечных организаций:
1.Аптеки, осуществляющие розничную торговлю (отпуск) лекарственных препаратов населению. Непроизводственные и производственные с правом изготовления
- лекарственных препаратов;
- изготовления асептических лекарственных препаратов;
2️.Аптеки в структуре медицинских организаций. Непроизводственные и производственные с правом изготовления
- лекарственных препаратов;
- изготовления асептических лекарственных препаратов;
- радиофармацевтических лекарственных препаратов.
3️.Аптечные пункты, в том числе в структуре медицинской организации.
Тара, упаковка и комплектность ЛП
Утратил силу 31.12.2020: Приказ Министерства здравоохранения Российской Федерации от 21 декабря 2016 г. N 979н «Об утверждении требований к объему тары, упаковке и комплектности лекарственных препаратов для медицинского применения».
Комментарий: Производство ЛП, предназначенных для внутреннего применения, а также их продажа и передача производители ЛС осуществляют в таре, содержащей объем лекарственного препарата:
-не более 25 мл при объемной доле спирта свыше 50% и курсовой дозе ЛП не более 75 мл включительно;
-не более 50 мл при объемной доле спирта от 30% до 50% и курсовой дозе ЛП не более 100 мл включительно;
-не более 100 мл при объемной доле спирта до 30% и курсовой дозе ЛП не более 200 мл включительно.
На первичной и вторичной (при наличии) упаковке указывается концентрация спирта, входящего в состав лекарственного препарата. Производители при продаже и передаче ЛП комплектуют в соответствии с инструкцией по медицинскому применению лекарственного препарата.
Утратил силу 31.12.2020: Приказ Министерства здравоохранения Российской Федерации от 8 февраля 2017 г. N 47н «Об утверждении перечня лекарственных препаратов для медицинского применения, в отношении которых устанавливаются требования к объему тары, упаковке и комплектности».
Комментарий: Утверждён перечень спиртосодержащих настоек, капель, экстрактов и эликсиров, в отношении которых устанавливаются требования Приказа 779н.
Санитарный режим в аптеках
Утратил силу 31.12.2020: Приказ Министерства здравоохранения Российской Федерации от 21 октября 1997 г. N 309 «Об утверждении Инструкции по санитарному режиму аптечных организаций (аптек)».
Комментарий: Пятый раздел данного постановления посвящен аптечным организациям и называется “Санитарно-эпидемиологические требования при предоставлении услуг аптечными организациями”
Качество ЛС
Утратили силу 31.12.2020:
- Приказ Министерства здравоохранения Российской Федерации от 16 июля 1997 г. N 214 «О контроле качества лекарственных средств, изготовляемых в аптечных организациях (аптеках)».
- Приказ Министерства здравоохранения Российской Федерации от 16 октября 1997 г. N 305 «О нормах отклонений, допустимых при изготовлении лекарственных средств и фасовке промышленной продукции в аптеках».
- Приказ Министерства здравоохранения Российской Федерации от 21 октября 1997 г. N 308 «Об утверждении Инструкции по изготовлению в аптеках жидких лекарственных форм».
4. Приказ Министерства здравоохранения Российской Федерации от 20 июля 2001 г. N 284 «Об утверждении норм естественной убыли лекарственных средств и изделий медицинского назначения в аптечных организациях независимо от организационно-правовой формы и формы собственности».
Комментарий: Когда Приказ 751н был опубликован, он не отменил действия приказов 214, 305, 308 и 284, что приводило к дублированию и разночтениям. Теперь данный недочет устранен.
Приказ 751н содержит не только правила изготовления разных видов лекарственных форм и виды контроля, а также всю необходимую информацию, используемую при изготовлении лекарственных препаратов в производственных аптеках.
Возврат товаров
Утратило силу 31.12.2020: Постановление Правительства РФ от 19 января 1998 г. N 55 «Об утверждении Правил продажи отдельных видов товаров, перечня товаров длительного пользования, на которые не распространяется требование покупателя о безвозмездном предоставлении ему на период ремонта или замены аналогичного товара, и перечня непродовольственных товаров надлежащего качества, не подлежащих возврату или обмену на аналогичный товар других размера, формы, габарита, фасона, расцветки или комплектации»
Вступило в силу 01.01.2021: Постановление Правительства РФ от 31 декабря 2020 г. N 2463 “Об утверждении Правил продажи товаров по договору розничной купли-продажи, перечня товаров длительного пользования, на которые не распространяется требование потребителя о безвозмездном предоставлении ему товара, обладающего этими же основными потребительскими свойствами, на период ремонта или замены такого товара, и перечня непродовольственных товаров надлежащего качества, не подлежащих обмену, а также о внесении изменений в некоторые акты Правительства Российской Федерации ”
Комментарий: Постановление № 2463 утверждает Перечень
непродовольственных товаров надлежащего качества, не подлежащих обмену, в том числе:
- Товары для профилактики и лечения заболеваний в домашних условиях (предметы санитарии и гигиены из металла, резины, текстиля и других материалов, медицинские изделия, средства гигиены полости рта, линзы очковые, предметы по уходу за детьми), лекарственные препараты.
- Предметы личной гигиены (зубные щетки, расчески, заколки, бигуди для волос, парики, шиньоны и другие аналогичные товары)
- Парфюмерно-косметические товары
- Чулочно-носочные изделия
- Технически сложные товары бытового назначения, на которые установлены гарантийные сроки не менее одного года
Вступившие в силу изменения в некоторых случаях облегчают жизнь аптек, например, постановление N 1447, где утверждены более длительные сроки уничтожения некачественных ЛС. Другие постановления не содержат в себе глобальных изменений и не создают дополнительных нагрузок для работников аптек.
Безусловно, в любом случае, эти нормативные акты придется изучить и скорректировать свою работу. Напишите нам — детальный юридический разбор какого блока обновлений вам бы хотелось видеть в следующей правовой публикации.
Отвечаем на вопросы в прямых эфирах Вконтакте: https://vk.com/pharmznanie
Обсудить последние новости со всеми коллегами России вы можете в чатах:
Чтобы оставить комментарий к статье, вам нужно зарегистрироваться или войти .
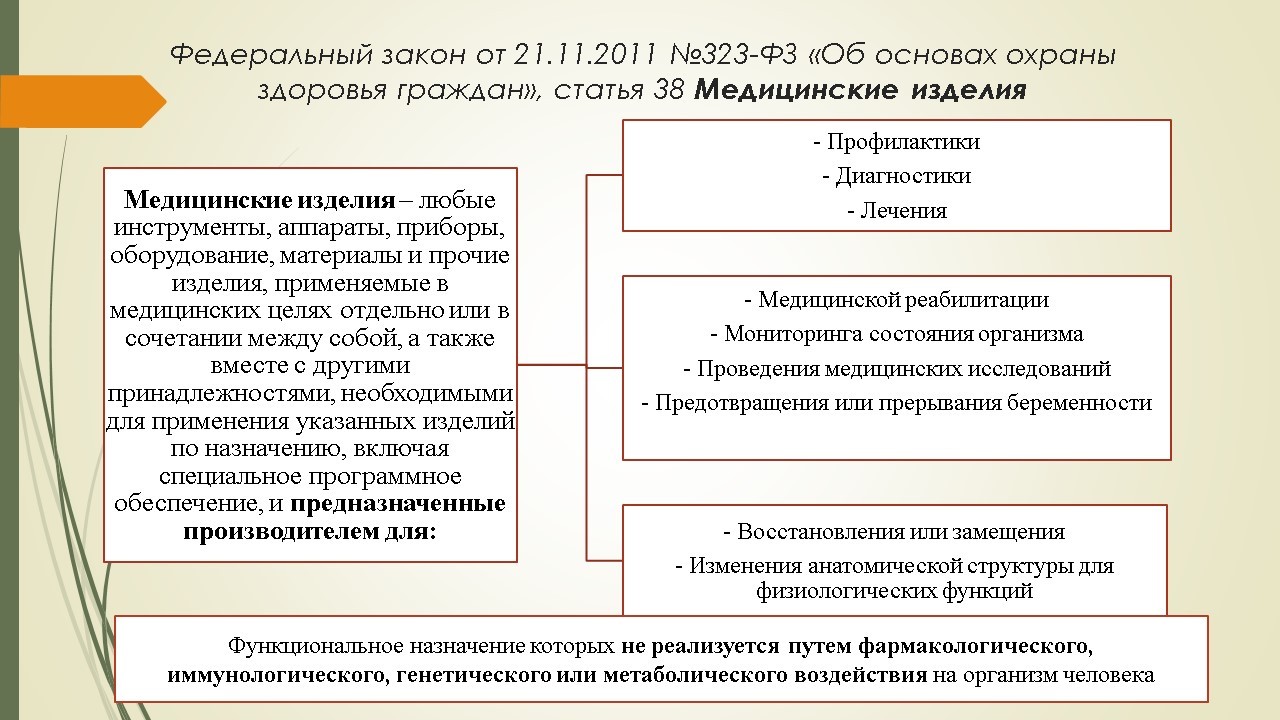
Обращение медицинских изделий в розничных фармацевтических сетях
На данный момент обращение медицинских изделий, как вид предпринимательской деятельности, требует предварительного уведомления Росздравнадзора, что регламентировано Постановлением Правительства РФ №584 «Об уведомительном порядке начала осуществления отдельных видов предпринимательской деятельности», а также Федеральным законом №294 «О защите прав юридических лиц и индивидуальных предпринимателей при осуществлении государственного контроля (надзора) и муниципального контроля»: уведомление представляется после государственной регистрации и постановки на учет в налоговом органе до начала фактического выполнения работ или предоставления услуг (может быть в форме электронного документа).
За непредоставление указанного уведомления предусмотрена административная ответственность в виде наложения штрафа на должностное лицо в размере от 3 до 5 тыс.р., на юридическое лицо – от 10 до 20 тыс.р. (ч. 1 ст. 19.7.5 КоАП РФ).
Однако следует отметить, что предоставлять данное уведомление обязаны только те розничные фармацевтические организации, которые стали заниматься указанным видом деятельности позднее 18 декабря 2014 года (те, кто начал свою деятельность до указанной даты, освобождаются от уведомления).
Рассмотрим нормативно-правовое регулирование обращения медицинских изделий в разрезе основных процессов, которые происходят в розничной фармацевтической организации от момента поступления медицинского изделия до момента реализации конечному потребителю (отпуска) или уничтожения.
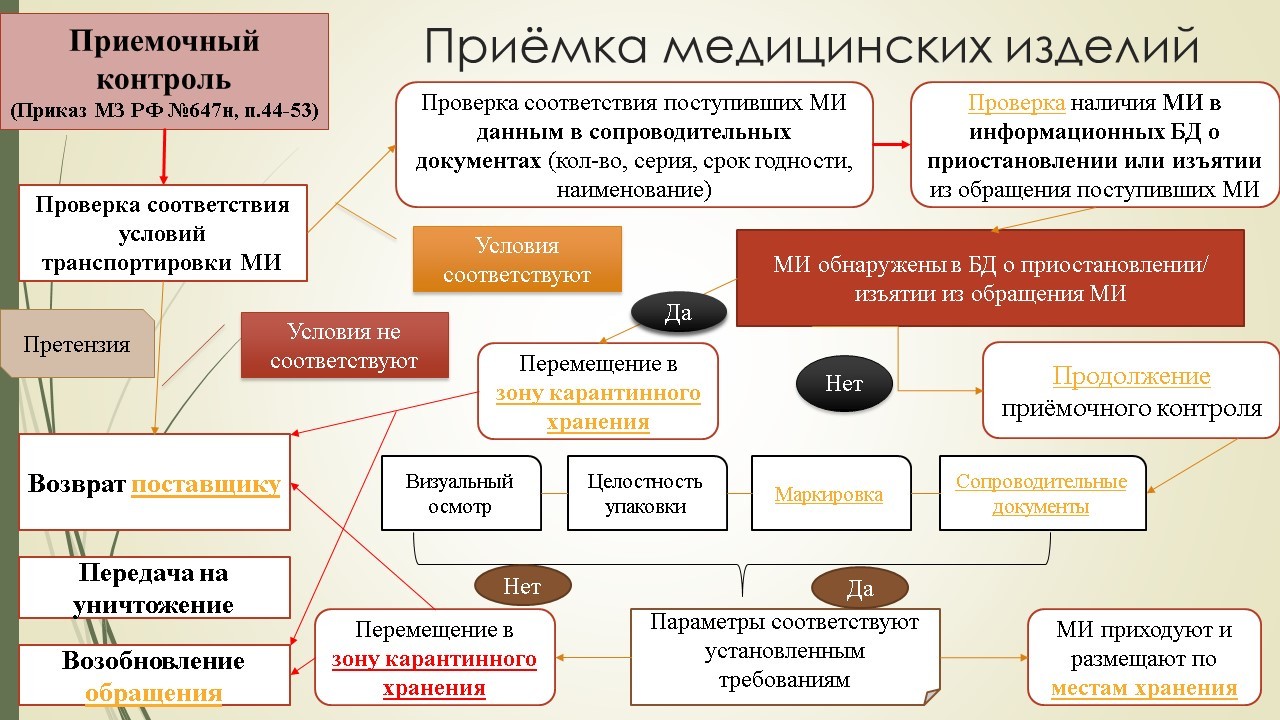
1. Приемка медицинских изделий.
Сама схема приемки медицинских изделий укладывается в общую схему приемки всех товаров аптечного ассортимента. Основные моменты, касающиеся порядка проведения приемочного контроля изложены в Приказе 647н «Об утверждении Правил надлежащей аптечной практики лекарственных препаратов для медицинского применения». Весь процесс начинается с проверки соблюдения условий транспортировки, соответствия поступивших медицинских изделий данным в сопроводительных документах (очень важно в данном случае проверить наличие их в информационных базах данных о приостановлении или изъятии из обращения медицинских изделий).
После проверки наличия поступивших медицинских изделий в указанных информационных базах данных и выявления положительного результата необходимо переместить медицинское изделие в зону карантинного хранения. При отрицательном результате приемочный контроль продолжается и будет состоять из следующих стадий: контроль качества, визуальный осмотр, целостность упаковки, маркировка и проверка сопроводительной документации.
Если по перечисленным параметрам медицинское изделие соответствует установленным требованиям, оно приходуется и размещается на основное место хранения; если нет – перемещается в зону карантинного хранения и либо возвращается поставщику (на условиях, прописанных в договоре) и уничтожается, либо возвращается в обращение (если поступила информация о возобновлении обращения).
Рассмотрим подробнее информационные базы данных о фальсифицированных, контрафактных и недоброкачественных медицинских изделиях.
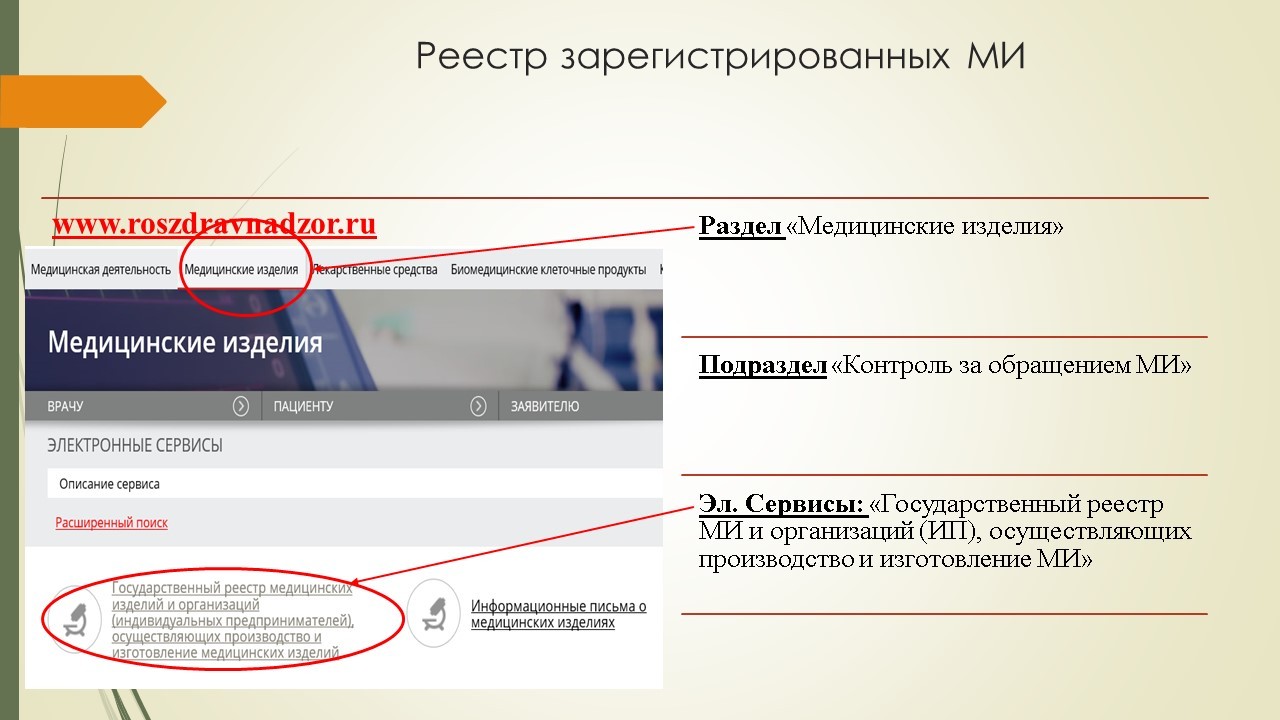
На официальном сайте Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) есть раздел «Медицинские изделия» (подраздел «Контроль за обращением медицинских изделий», электронный сервис «Информационные письма о медицинских изделиях»).
Если на этом этапе выясняется наличие медицинского изделия в базе данных, согласно Федеральному закону №323 «Об основах охраны здоровья граждан» оно не имеет права реализовываться и в дальнейшем фальсифицированные и недоброкачественные медицинские изделия подлежат изъятию и уничтожению или вывозу, а контрафактные – изъятию и только последующему уничтожению.
Порядок уничтожения регламентирован Постановлением Правительства №1360 «Об отдельных вопросах противодействия обороту фальсифицированных, недоброкачественных и контрафактных медицинских изделий».
Один из параметров качества медицинского изделия – маркировка (именно этот параметр требует особого разъяснения, так как на данный момент нет единого нормативного документа, который содержал бы совокупную информацию о том, какая маркировка на медицинских изделиях должна быть).
Первый нормативный документ, регламентирующий маркировку – Постановление Правительства №1037 «О мерах по обеспечению наличия на ввозимых на территорию РФ непродовольственных товарах информации на русском языке», который говорит о том, что все ввозимые на территорию Российской Федерации и предназначенные для дальнейшей реализации медицинские изделия должны содержать определенный перечень данных на русском языке, а также указывает, где данная информация должна присутствовать.
Также хотелось бы обратить внимание на еще один документ — Решение Совета Евразийской экономической комиссии №30, который посвящен порядку формирования и ведения единой информационной системы в сфере обращения медицинских изделий. В п. 14 Раздела II документа присутствует информация о перечне сведений, которые должны быть указаны в данной информационной системе:
«Единый реестр содержит следующие сведения:
у) изображение маркировки медицинского изделия (в электронном виде)»
Далее рассмотрим нормативные акты, регламентирующие сопроводительные документы к медицинским изделиям.
В целом данные нормативные акты можно разделить на две группы:
— касающиеся порядка регистрации информации, которая должна присутствовать и которую мы должны предоставлять потребителю;
— касающиеся подтверждения соответствия поступающих медицинских изделий.
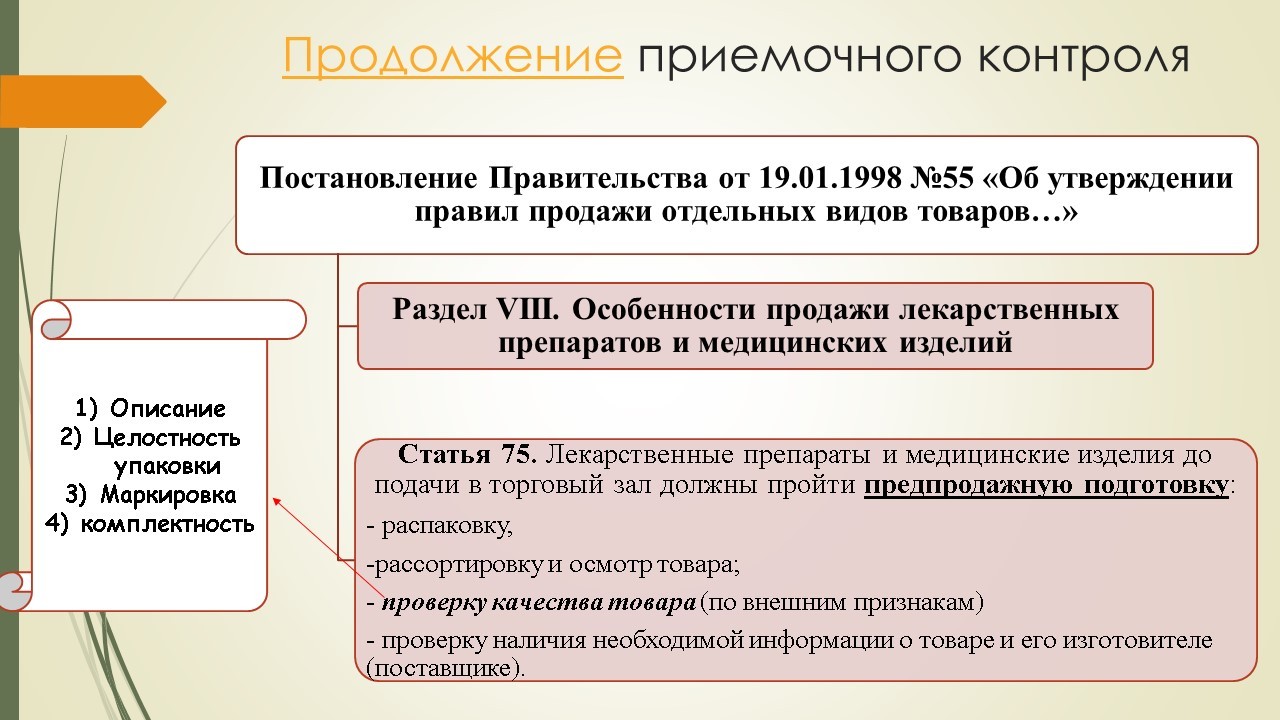
Согласно Постановлению Правительства №55 «Об утверждении Правил продажи отдельных видов товаров…», на медицинское изделие должна быть предоставлена информация о номере и дате регистрационного удостоверения.
Следует помнить, что регистрационные удостоверения, имеющие ограниченный срок действия и выданные до момента вступления в силу Постановления Правительства №1416 «Об утверждении правил государственной регистрации МИ», действуют до истечения их срока действия.
Регистрационные удостоверения бессрочного действия, выданные до дня вступления в силу настоящего постановления, действительны и подлежат замене до 1 января 2021 г. на регистрационные удостоверения нового образца.
Что касается подтверждения соответствия медицинских изделий, оно может быть в виде декларирования соответствия или обязательной сертификации. Конкретные виды медицинских изделий, которые подлежат либо декларированию либо обязательной сертификации можно найти в Постановлении Правительства РФ N 982 «Об утверждении единого перечня продукции, подлежащей обязательной сертификации, и единого перечня продукции, подтверждение соответствия которой осуществляется в форме принятия декларации о соответствии».
Обязанность проходить процедуру соответствия возложена ст. 28 Федерального закона № 184-ФЗ «О техническом регулировании».
Заявитель обязан:
— обеспечивать соответствие продукции требованиям технических регламентов;
— выпускать в обращение продукцию, подлежащую обязательному подтверждению соответствия, только после осуществления такого подтверждения соответствия;
— указывать в сопроводительной документации сведения о сертификате соответствия или декларации о соответствии;
— предъявлять в органы государственного контроля (надзора) за соблюдением требований технических регламентов, а также заинтересованным лицам документы, свидетельствующие о подтверждении соответствия продукции требованиям технических регламентов (декларацию о соответствии, сертификат соответствия или их копии) либо регистрационный номер сертификата соответствия или декларации о соответствии.
Заявитель — физическое или юридическое лицо, которое для подтверждения соответствия принимает декларацию о соответствии или обращается за получением сертификата соответствия, получает сертификат соответствия.
Информация, которая должна быть указана в товарно-сопроводительных документах, регламентирована Постановлением Правительства РФ №55 «Об утверждении Правил продажи отдельных видов товаров…»:
— о декларации (регистрационный № декларации, срок её действия, наименование организации, принявшей декларацию и орган, её зарегистрировавший);
— о сертификате (№ сертификата, срок его действия и орган, выдавший сертификат).
Посмотреть наличие действующей декларации/сертификата можно на сайте РосАккредитации в разделе «Реестры» в рубрике «Единый реестр деклараций о соответствии» либо «Единый реестр сертификатов соответствия».